Der Name verrät es bereits: Wer mit einem Rotationsverdampfer arbeitet, der möchte etwas verdampfen. Diesen Vorgang kennt man in der Küche hauptsächlich als Bestandteil des Reduzierens: Soßen werden eingekocht, um den Geschmack zu intensivieren. Dabei passiert nichts anderes, als dass der in der Soße befindliche Wasseranteil durch Kochen verringert wird, indem man das Wasser als Dampf entweichen lässt. Das Resultat ist eine eingedickte Soße mit intensivem Aroma. Das Zielprodukt ist hier also nicht der Wasserdampf, sondern natürlich das, was im Topf zurückbleibt. Was allerdings noch dabei passiert, ist, dass sogenannte leichtflüchtige Aromen durch die Hitze mit dem Wasserdampf entweichen und damit verloren gehen. Manche Geschmacksträger werden durch die Einwirkung der Hitze auch zerstört. Ein gutes Beispiel, das diesen Effekt veranschaulicht, ist, wenn man den Geschmack frischer Früchte mit dem von eingekochter Marmelade vergleicht.
Was aber ist, wenn man die Möglichkeit hätte, diese leichtflüchtigen Aromen mit dem Wasserdampf aufzufangen und ebenfalls zu verwenden? Oder, wenn man bei niedrigeren Temperaturen arbeiten könnte, die das Aroma schonen, aber trotzdem zum erwünschten Ergebnis führen?
Genau hier kommt der Rotationsverdampfer ins Spiel!
Um zu verstehen, wie dieses Gerät funktioniert, müssen wir uns näher mit dem Grundprinzip des Verdampfens auseinandersetzen – und keine Sorge, es ist alles gar nicht so komplex, wie man meint!
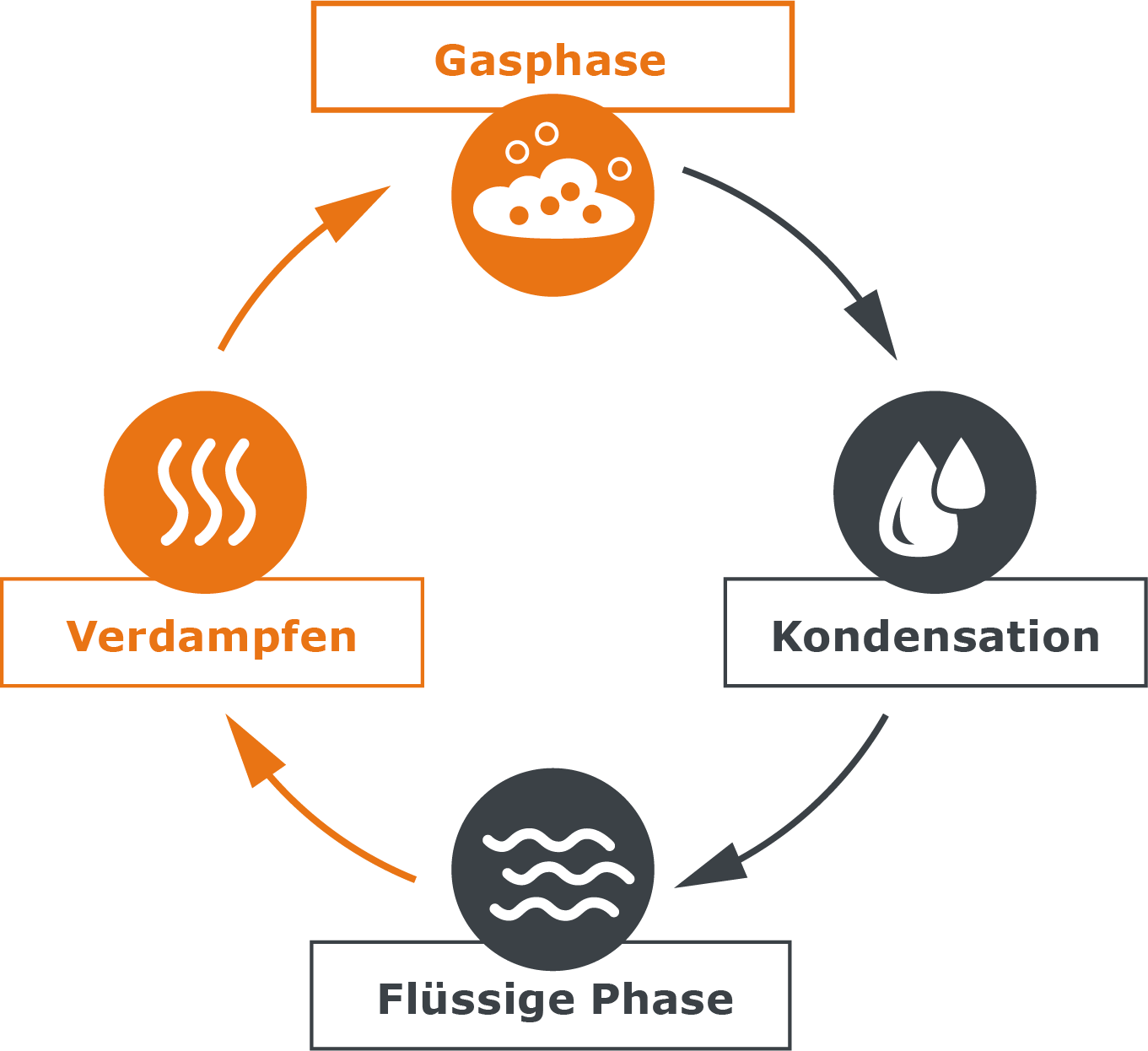
Verdampfen bedeutet in der Physik: Eine Flüssigkeit, z. B. Wasser, wird zu einem Gas. Sie ändert also ihren Zustand (Aggregatzustand) von flüssig zu gasförmig. Man sagt auch: Die Substanz geht von der flüssigen Phase in die Gasphase über.
Bleiben wir bei unserem Kochtopf mit Wasser als Modell: Wenn wir den Topf einfach auf dem Tisch platzieren, so wird nach einer langen Zeit das Wasser scheinbar verschwinden. Aber es ist nicht einfach weg: Es ist verdampft. Nach und nach geht das Wasser also von der flüssigen Phase in die Gasphase über – ohne, dass wir etwas dazu beitragen.
Um zu verstehen, warum das passiert, müssen wir uns auf eine Ebene begeben, die das menschliche Auge nicht auflösen kann. Wir betrachten mit Hilfe von Prof. Hei's Moleküllupe das Wasser im Topf einmal näher:
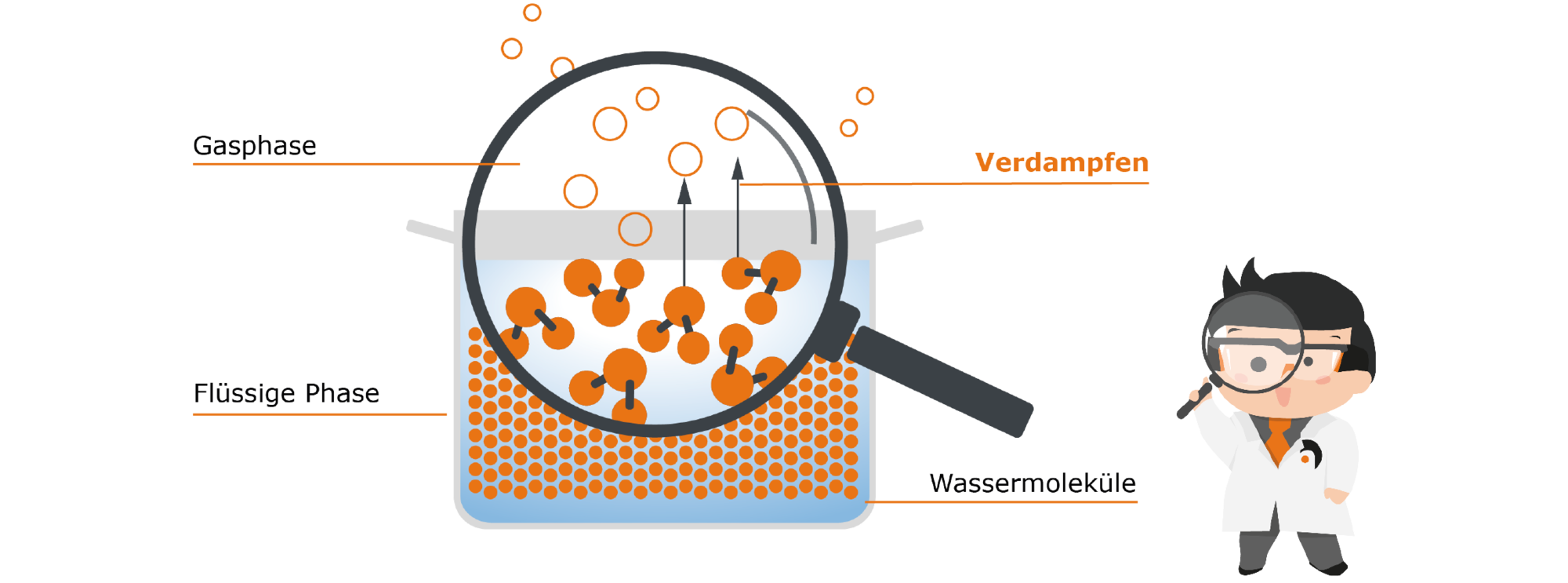
Im flüssigen Wasser befinden sich die Wassermoleküle sehr dicht beieinander und halten sich sogar durch sogenannte zwischenmolekulare Bindungen, also Bindungskräfte zwischen den einzelnen Molekülen, fest.

Dabei liegen sie jedoch nicht einfach statisch wie Murmeln im Topf, sondern sie bewegen sich ständig. Durch diese Bewegungen kommt es immer wieder zu Stößen der Moleküle gegeneinander, wodurch Bewegungsenergie vom einen auf das andere Molekül übertragen wird. Bekommt ein einzelnes Molekül besonders viele dieser Stöße, so erhält es die nötige Energie, um die Bindungen zu seinen Partnermolekülen aufzulösen – sich also aus der Enge der Flüssigkeit zu befreien und aus ihr aufzusteigen. Diese gewonnene Freiheit ist für das Molekül erstrebenswert – nachvollziehbar, oder? Wer lässt sich schon gerne einengen? Deshalb streben Moleküle immer danach, möglichst viel Freiheit zu gewinnen – sie gehen also von der Flüssigkeit in die Gasphase über, sobald sie die nötige Energie dafür bekommen.
Wie viel Energie eine Substanz dafür benötigt, ist je nach Art der Substanz unterschiedlich. Da im Gastronomiebereich hauptsächlich mit Wasser oder Trinkalkohol (Ethanol) gearbeitet wird, vergleichen wir diese beiden Flüssigkeiten: Um ein Kilogramm Alkohol zu verdampfen, benötigt man 837 KJ Energie. Für ein Kilogramm Wasser sind es dagegen schlappe 2.261 KJ. Dies erklärt, wieso ein Verdampfungsprozess mit Wasser, zum Beispiel bei der Herstellung von Hydrolaten oder Reduktionen/Konzentraten, immer deutlich langsamer abläuft als beim Arbeiten mit Alkohol.
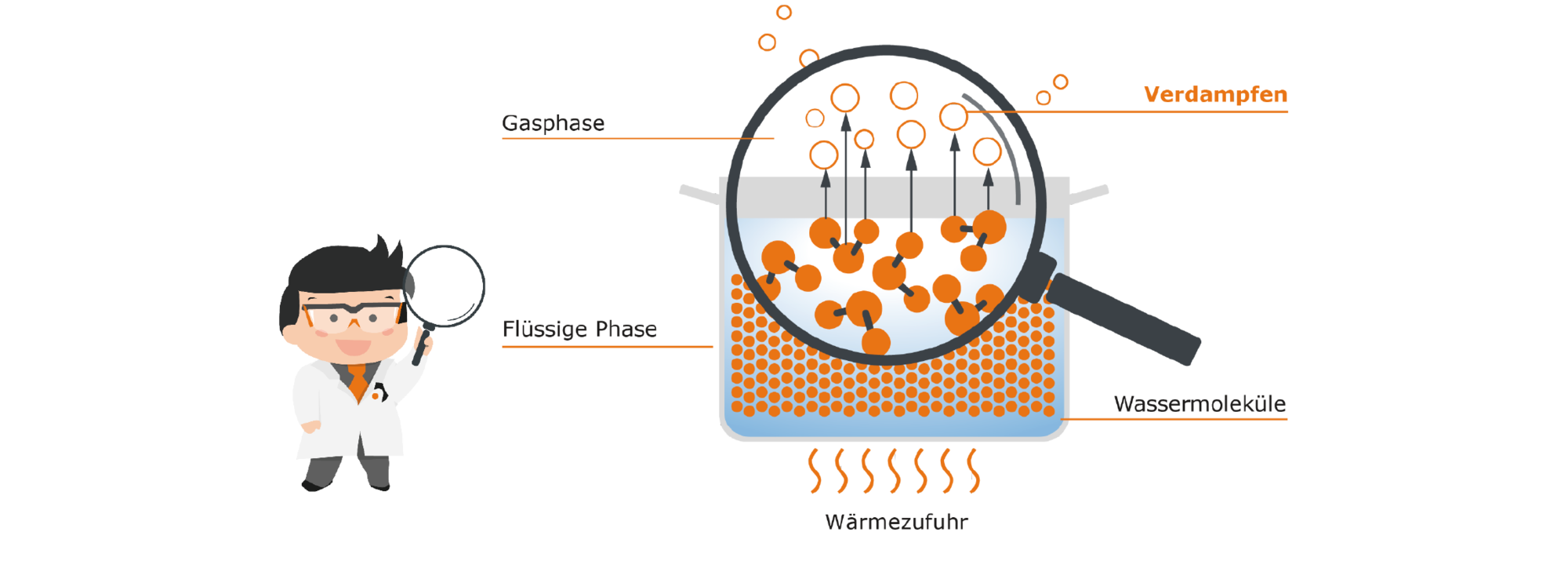
Wie kann man diesen natürlichen Verdampfungsprozess nun beschleunigen? Die bekannteste Methode ist das Ganze zu erhitzen, womit wir wieder zum bekannten Vorgang des Reduzierens kommen: Wir stellen unseren Topf mit Wasser auf die Herdplatte. Wärme ist eine Form der Energie. Sie sorgt dafür, dass unsere Moleküle diese Energie aufnehmen und somit viel agiler werden. Es kommt auch zu einer Erhöhung der Stöße der Moleküle untereinander. Daraus ergibt sich, dass durch die zugeführte Wärme wesentlich mehr Moleküle die nötige Energie erhalten, um sich aus der flüssigen in die gasförmige Phase zu begeben. Durch die Wärmezufuhr verdampft also mehr Wasser.
Die maximal mögliche Menge an Dampf wird beim Erreichen der Siedetemperatur (also für Wasser 100 °C) erzeugt.
Befinden sich in dem Topf nun neben Wasser noch andere Komponenten, beispielsweise Kräuter oder Früchte, so enthält der entstandene Dampf nicht nur reines Wasser, sondern auch die leichtflüchtigen Aromen: Sie sind kleine, unterschiedliche Moleküle, die für den Geruch und Geschmack essentiell sind. Zusammen mit den schwerflüchtigen Aromen, die im Topf zurückbleiben, ergibt dieser „Molekülcocktail“ das charakteristische Geruchs- und Geschmacksprofil der verwendeten Komponente. Beim Kochen im Topf verschwinden diese leichtflüchtigen Aromen also mit dem aufsteigenden Wasserdampf – und damit ein nicht unwesentlicher Anteil des Geschmacks. Häufig sind Aromen auch hitzeempfindlich und werden durch zu hohe Wärmeeinwirkung zerstört, was mit einem weiteren Verlust einhergeht.
Eine andere Möglichkeit, das Verdampfen zu beschleunigen, ist den Druck zu verringern. Unser Topf mit Wasser ist, genauso wie alles andere, dem Atmosphärendruck ausgesetzt. Dieser schwankt je nach geographischer Höhe, kann aber grob mit 1000 mbar angegeben werden. Dieser Druck wirkt dem Übergang unserer Wassermoleküle von der flüssigen in die Gasphase entgegen. Stellen wir uns nun vor, wir würden den Atmosphärendruck reduzieren, z.B. von 1000 mbar auf 100 mbar: Trotz derselben zugeführten Energiemenge können nun wesentlich mehr unserer Moleküle aus der flüssigen Phase in die gasförmige Phase übergehen.
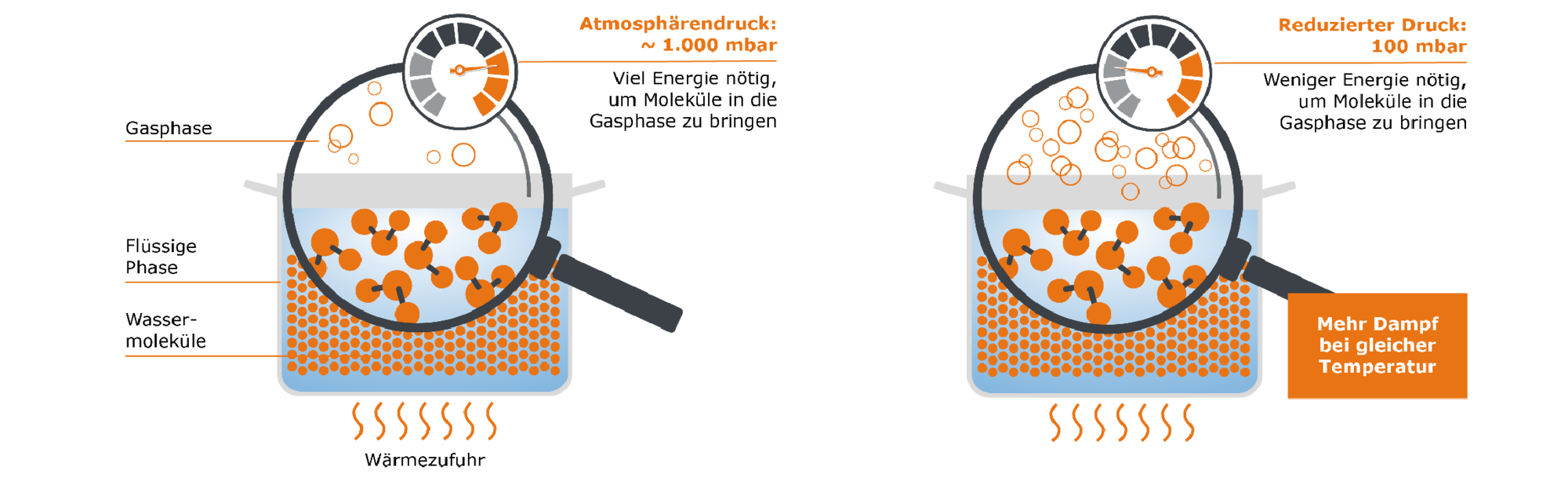
Hieraus lässt sich ein einfacher Grundsatz ableiten: Je niedriger der Druck, desto einfacher kann eine Substanz verdampfen und desto weniger Hitze wird zum Verdampfen benötigt. Die maximal mögliche Menge an Dampf kann also bereits bei niedrigeren Temperaturen erzeugt werden (z. B. 50 °C für Wasser bei 100 mbar). Hier kommen wir zum springenden Punkt, der beim Aromenmanagement mit dem Rotationsverdampfer eine besondere Rolle spielt: Durch die Möglichkeit, bei reduziertem Druck, also im Vakuum zu arbeiten, werden empfindliche Aromen, die sonst durch Erhitzen zerstört werden, bewahrt.
Nachdem wir nun verstehen, wie aus Wasser Dampf wird, müssen wir uns jetzt noch mit dem umgekehrten Prozess beschäftigen: Wie wird aus Dampf wieder eine Flüssigkeit? Die Antwort lautet: Durch Kondensation. Eine Substanz geht von der gasförmigen in die flüssige Phase über. Das passiert, wenn unseren befreiten Wassermolekülen die Energie, die wir ihnen zugeführt haben, wieder entzogen wird. Dies geht am einfachsten durch Kälte.
Um uns dem Phänomen der Kondensation zu nähern, bedienen wir uns wieder unseres Beispiels des Topfes mit Wasser: Schließen wir den Topf mit einem Deckel, kann der Dampf nicht mehr einfach entweichen, sondern er wird in diesem geschlossenen System des Topfinneren verbleiben. Gleichzeitig ist der Deckel des Topfes kühler als der Rest: Unsere befreiten Wassermoleküle stoßen also auf diese kühle Barriere und geben einen Teil ihrer Energie an den kühleren Deckel ab. Es findet ein Temperaturausgleich statt. Die Moleküle sammeln sich an der kalten Oberfläche zu Tropfen. Sie kondensieren, daher nennt man das kondensierte Wasser auch ‚Kondensat‘. Irgendwann sind die Tropfen schwer genug und fallen zurück in die Flüssigkeit, wo die Moleküle wieder mit Energie versorgt werden und erneut aufsteigen können.
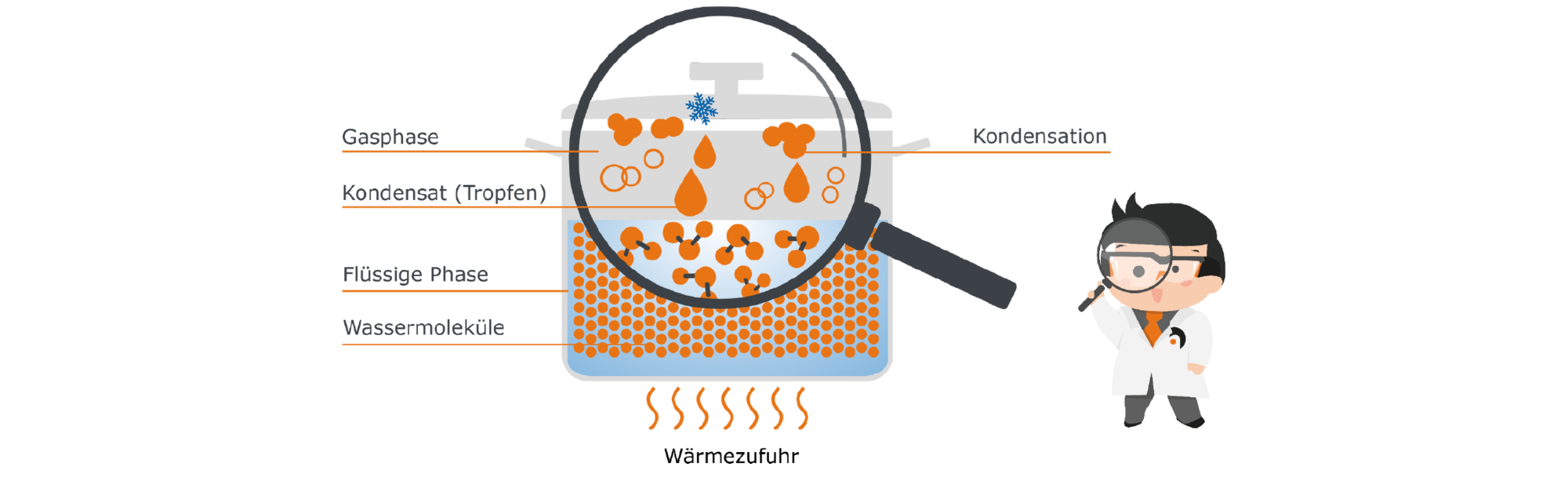
Es bildet sich ein Kreislauf von Verdampfen und Kondensation, der im Gleichgewicht steht.
Wie macht man sich dieses Gleichgewicht aus Verdampfen und Kondensation nun beim Rotationsverdampfer zu Nutze? Betrachten wir den Aufbau eines Rotationsverdampfers, so lässt dieser sich in zwei Bereiche einteilen: Den Verdampfungsbereich, in dem eine Substanz von der flüssigen in die gasförmige Phase überführt wird, und den Kondensationsbereich, in dem das Gas wieder zur Flüssigkeit kondensiert wird.
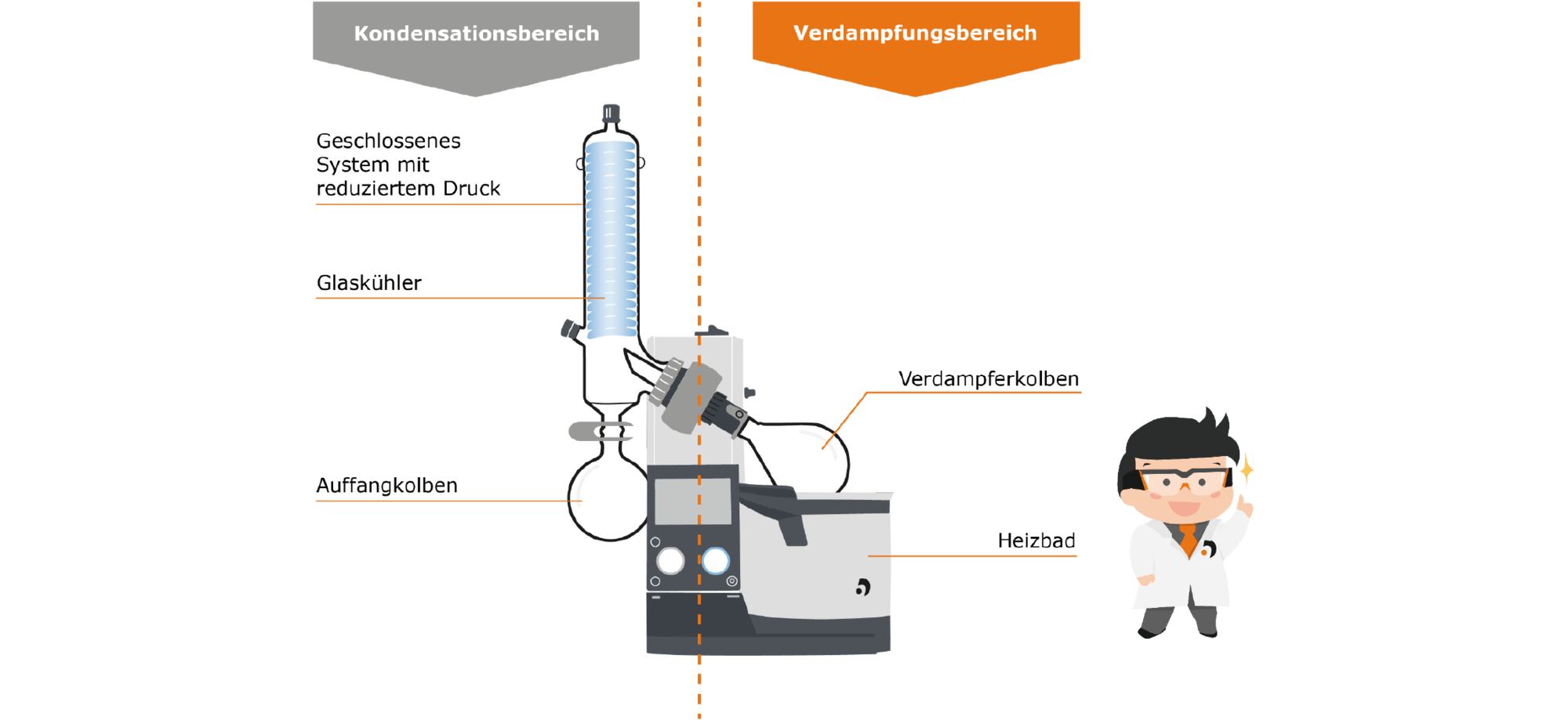
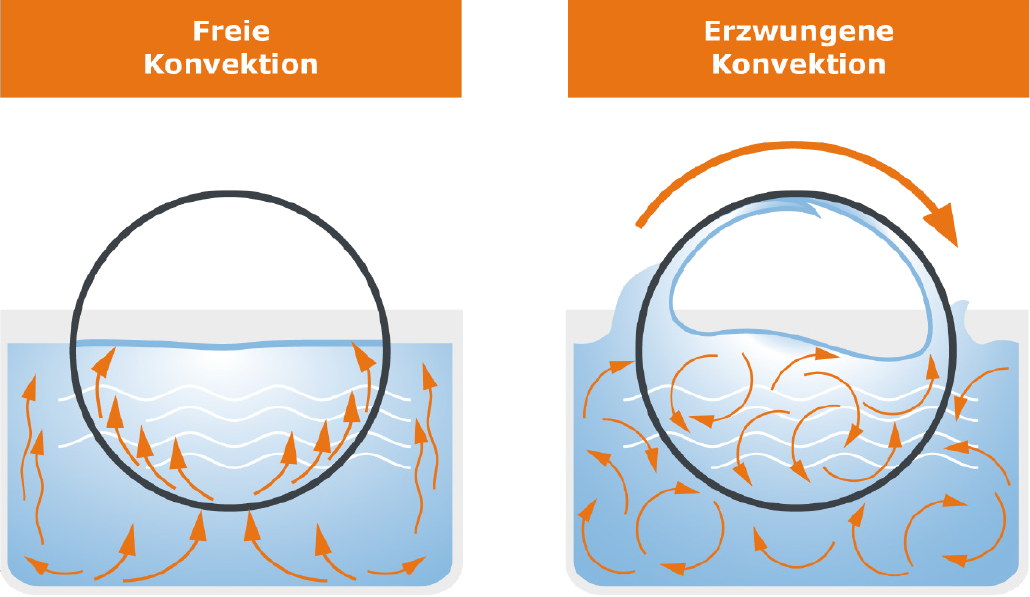
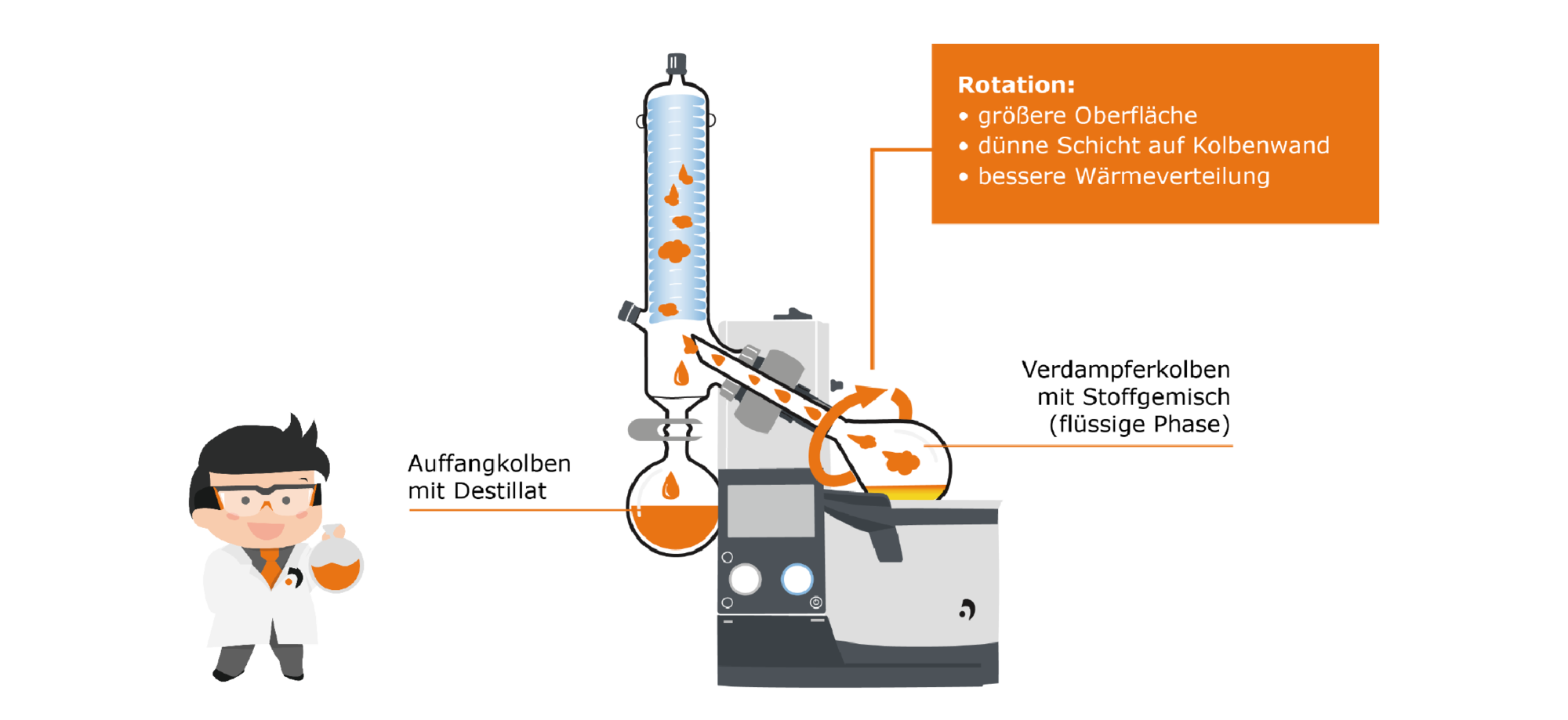
Sehen wir uns zunächst den Verdampfungsbereich näher an: Den Verdampferkolben, in dem sich das flüssige Medium befindet. Dieser Kolben wird in das Heizbad getaucht, das die zum Verdampfen nötige Energie zuführt. Der Kolben wird durch einen Motor in eine Rotation versetzt. Das hat mehrere Effekte: Zum einen findet die Temperaturverteilung im Heizbad und innerhalb des Kolbens gleichmäßiger statt, zum anderen wird durch die Rotation die zum Verdampfen verfügbare Oberfläche deutlich erhöht und ein dünner Film an Flüssigkeit aufgetragen, der sehr leicht wegverdampfen kann. Dies wirkt sich positiv auf die Verdampfungsgeschwindigkeit aus und unterdrückt die Bildung von Blasen und Spritzern.
Durch das Dampfleitrohr steigt der erzeugte Dampf auf in die Kondensationszone: Hier befindet sich ein mit einem Kühlmittel gekühlter Glaskühler, an dem der Dampf kondensiert und nach unten in den Auffangkolben tropft.
Der ganze Prozess wird unter durch eine Vakuumpumpe reduziertem Druck durchgeführt, um die oben bereits genannten Vorteile zu nutzen: Ein niedrigerer Energieeintrag ist notwendig, um das Verdampfen auszulösen und somit werden die Stoffe schonender bearbeitet. Aromen, die durch zu hohe Wärmeeinwirkung zerstört würden, werden sanft extrahiert und bleiben erhalten.
Zudem gewährt einem die Arbeit mit einer Vakuumpumpe Zugriff auf einen sehr schnell anpassbaren Parameter, um die Prozessgeschwindigkeit zu beeinflussen, da keine langen Wartezeiten, wie zum Beispiel durch die Trägheit eines Heizbades, erforderlich sind. Auch erlaubt diese Möglichkeit der Feinjustierung es, Aromen gezielt ‚abzuschneiden‘ und so zu extrahieren, wie man sie haben möchte.
Ist man stattdessen an den schwerflüchtigen Aromen interessiert, so bietet sich am Rotationsverdampfer die Möglichkeit, bei niedrigen Temperaturen Soßen, Säfte oder andere Flüssigkeiten zu reduzieren und damit ihren Geschmack zu intensivieren.
Alles in allem bieten sich dadurch unzählige Möglichkeiten, sich im Aromenmanagement auszuprobieren und kreativ zu werden.